För en lekman kan det framstå som ett mysterium att två gaser som slår sig samman och bildar vatten, trots konstant temperatur, blir till flytande form. Detta ska jag försöka att lösa här med två relativt enkla delförklaringar. Den nära släkting till vatten, väteperoxid, kommer också att tas med i förklaringen.
Det korta svaret är att vatten som molekyl har lägre energi samt har starka inre bindningar. Detta gör att vattenmolekyler rör sig långsammare än molekyler i gasform samtidigt som vattenmolekyler lätt fastnar i varandra och bildar stora molekyler. På detta vis håller sig vatten i flytande form.

I rumstemperatur är väte en gas och detsamma gäller syre. Dessa två gaser är uppbyggda av atomer som binder sig till varandra i par. Väte och syre är alltså i naturligt tillstånd inte rena atomer utan små molekyler. Väte i luften är H2 och syre i luften är O2. Detta behövs som en utgångspunkt för vad som händer sedan när dessa gaser blir till vatten.
En vattenmolekyl har som de flesta vet den kemiska formeln H2O. Det betyder att den består av två väteatomer och en syreatom. Väteperoxid är en ren förening mellan H2 och O2 så dess kemiska formel är H2O2. Både vatten och väteperoxid har flytande form vid rumstemperatur och båda är genomskinliga eller har en lätt blåaktig färg. Vatten går att dricka medan väteperoxid är frätande.
Vatten innehåller lägre energi
Eftersom väte består av två väteatomer (H2) och syre består av två syreatomer (O2) måste det till två vätemolekyler (2 x H2) plus en syremolekyl (O2) för att två vattenmolekyler ska bildas (2 x H2 + O2 = 2 x H2O + energi). Att det står plus energi i formeln när vattenmolekyler bildas beror på att det frigörs energi när syremolekylen delas i två syreatomer som binder sig till varsin vätemolekyl. Det är alltså nödvändigt att O2 splittas för att det ska bli en syreatom vardera som binder sig till en vätemolekyl så att dessa tillsammans bildar en vattenmolekyl.
Detta är en delförklaring till att vatten är i flytande form istället för i gasform när vatten är en förening av två gaser. Molekyler som är i gasform har hög energi vilket gör att de rör på sig snabbt. När de förlorar energi tappar de också fart och börjar närma sig flytande form där molekylerna är långsammare. När molekyler är i fast form är de nästan stilla.
När vatten bildas tack vare att syremolekylen splittas förlorar molekylerna som bildas energi och de rör sig därför långsammare och befinner sig närmare varandra.
Syremolekyler splittas hela tiden till fria syreatomer, även om de utgör en liten andel av allt syre i luften, som har chans att binda sig till andra atomer och molekyler. Om de inte hittar andra bindningar återgår de för det mesta till att binda sig med en fri syreatom och åter bilda ett par.
Vatten har täta bindningar
En vattenmolekyl har något som kallas en kovalensbindning eller kovalent bindning. En sådan bindning involverar ofta väte och det finns särskilda väte-bindningar där väte förenas med kväve, fosfor eller syre. Dessa bindningar är starka och är orsaken till att vatten har en hög kokpunkt jämfört med många andra ämnen som är flytande i rumstemperatur.
Starka bindningar med låg energi är mer stabila än bindningar med hög energi. Eftersom syremolekylen tappar energi när vatten bildas kan vi säga att vattenmolekylen har relativt låg energi och det är en delförklaring till att molekylen är stabil och att den har flytande form i en stor variation av miljöer, lufttryck och temperaturer.
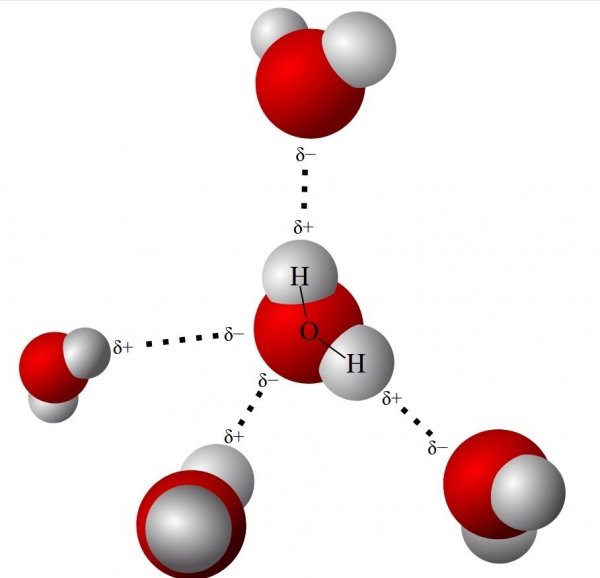
Att atomerna är nära varandra i vatten är alltså en delförklaring till att vatten huvudsakligen har flytande form och inte gasform. En fortsättning på detta är att atomerna i molekylen har olika laddning som gör att de attraherar andra molekyler. Väteatomerna är positivt laddade så de attraherar de negativt laddade syreatomerna i vattenmolekyler. På detta visa klumpar vattenmolekyler ihop sig och skapar en högre täthet. Tätheten gör att det blir stora och tunga molekyler och stora molekyler har svårare att behålla gasform.
Skillnaden mellan vatten och väteperoxid
Vatten är i flytande form i rumstemperatur för att bildandet av en vattenmolekyl leder till en energiförlust. Denna minskning i energi gör molekylen stabilare och detta stärks av det faktum att vattenmolekyler har starka kovalenta bindningar och positivt respektive negativt laddade atomer som attraherar andra vattenmylekyler att binda sig.
Väteperoxid är en mer instabil molekyl som med tiden sönderfaller till vatten och syre. Väteperoxid har alltså högre energi och mindre starka bindningar än vatten. Samtidigt är det en större molekyl än vatten som kan vara en rimlig förklaring till varför den, så länge den varar, behåller flytande form i rumstemperatur.
Nyckelord för att lära dig mer om vatten, dess släktingar och dess beståndsdelar är: gasform, flytande form, kovalent bindning, jonisering, energi, termodynamik och termokemisk.
Läs mer om varför väte och syre oftare i förening bildar vatten än väteperoxid.
Läs mer om olika sätt att bilda vatten.
Andra inlägg
- Mikael Jensen - ett personporträtt (AI-genererad)
- Oväntade möten med djur
- Lära svenska online
- Ny antologi: Lärarens ledarskap
- Vad ska jag vara mest nöjd med - högt IQ eller högt EQ?
- Ny bok: Ledarskap mitt i verksamheten
- Jämför och pressa priset på el, försäkringar och lån
- Tainted Love
- Postnord
- Bloggen är tre år


